化学反应速率降低的原因分析
一、温度降低导致速率下降
化学反应速率与温度密切相关。当温度降低时,分子运动的能量减少,分子间的碰撞频率和碰撞能量都会下降,从而导致化学反应速率降低。这是因为:
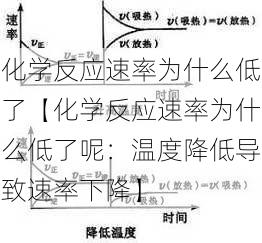
分子运动能量减少:温度降低意味着分子的平均动能降低,分子间的碰撞能量不足以克服反应所需的活化能。
碰撞频率下降:温度降低导致分子运动减慢,分子间的碰撞频率也随之减少,减少了反应发生的次数。
有效碰撞减少:在低温下,分子间的碰撞能量不足以形成反应过渡态,导致有效碰撞减少,反应速率降低。
二、反应物浓度降低
反应物浓度是影响化学反应速率的重要因素之一。当反应物浓度降低时,单位体积内的反应物分子数量减少,分子间的碰撞机会减少,从而导致反应速率降低。
碰撞机会减少:反应物浓度降低意味着单位体积内的反应物分子数量减少,分子间的碰撞机会也随之减少。
反应物分子分布不均:低浓度下,反应物分子在空间中的分布可能不均匀,导致某些区域反应速率降低。
三、催化剂失效或减少
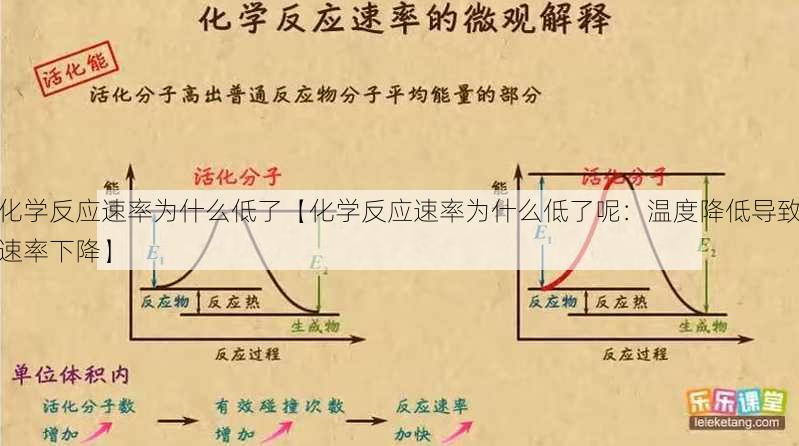
催化剂可以降低反应的活化能,从而加快反应速率。当催化剂失效或减少时,反应速率会降低。
催化剂失效:催化剂可能会因为化学腐蚀、物理磨损或其他原因而失效,失去催化作用。
催化剂减少:在反应过程中,催化剂可能会被消耗,导致催化剂数量减少,反应速率降低。
四、反应路径复杂化
某些化学反应的路径可能非常复杂,包括多个中间步骤和过渡态。这些复杂的路径会增加反应的活化能,从而降低反应速率。
活化能增加:复杂的反应路径意味着需要更多的能量来克服活化能,导致反应速率降低。
反应步骤增多:复杂的反应路径通常需要更多的反应步骤,增加了反应的复杂性,从而降低了反应速率。
五、溶剂性质改变
溶剂的性质,如极性、粘度等,也会影响化学反应速率。当溶剂性质改变时,可能会影响反应物分子的溶解度和反应路径,从而导致反应速率降低。
溶解度降低:溶剂性质改变可能导致反应物溶解度降低,从而减少反应物分子间的碰撞机会。
反应路径改变:溶剂性质的改变可能会改变反应路径,增加反应的活化能,从而降低反应速率。
六、常见问题解答
- 问:为什么高温有利于化学反应?
答:高温有利于化学反应,因为温度升高会增加分子运动的能量,提高分子间的碰撞频率和碰撞能量,从而增加有效碰撞次数,加快反应速率。
- 问:为什么反应物浓度越高,反应速率越快?
答:反应物浓度越高,单位体积内的反应物分子数量越多,分子间的碰撞机会增加,从而增加有效碰撞次数,加快反应速率。
- 问:催化剂在化学反应中起什么作用?
答:催化剂在化学反应中起到降低活化能的作用,从而加快反应速率,而自身在反应前后不发生变化。
- 问:为什么反应路径的复杂性会影响反应速率?
答:反应路径的复杂性会增加反应的活化能,需要更多的能量来克服,从而降低反应速率。
- 问:溶剂性质如何影响化学反应速率?
答:溶剂性质可以通过影响反应物的溶解度和反应路径来影响化学反应速率。
- 问:为什么低温下化学反应速率会降低?
答:低温下分子运动的能量减少,分子间的碰撞频率和碰撞能量都下降,导致有效碰撞次数减少,从而降低化学反应速率。
